您现在的位置是: 首页 > 分数线 分数线
高考氧化还原滴定-高考氧化还原滴定相关计算例题
tamoadmin 2024-08-14 人已围观
简介1.氧化还原滴定Ca2+的步骤有哪些?2.氧化还原反应综合应用:氧化还原反应滴定(1)配平氧化还原反应方程式:C 2 O 4 2 - + MnO 4 -氧化还原滴定Ca2+的步骤有哪些?氧化还原滴定Ca2+的大体的思路是:先用草酸钠将Ca2+沉淀,过滤得到CaC2O4沉淀,用硫酸溶解沉淀,得到H2C2O4再用KMnO4滴定H2C2O4用EDTA络合滴定要容易得多,标定EDTA后直接滴
1.氧化还原滴定Ca2+的步骤有哪些?
2.氧化还原反应综合应用:氧化还原反应滴定(1)配平氧化还原反应方程式:C 2 O 4 2 - + MnO 4 -
氧化还原滴定Ca2+的步骤有哪些?
氧化还原滴定Ca2+的大体的思路是:
先用草酸钠将Ca2+沉淀,
过滤得到CaC2O4沉淀,
用硫酸溶解沉淀,得到H2C2O4
再用KMnO4滴定H2C2O4
用EDTA络合滴定要容易得多,
标定EDTA后直接滴定就行了
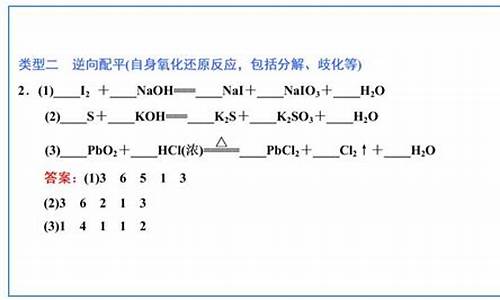
氧化还原反应综合应用:氧化还原反应滴定(1)配平氧化还原反应方程式:C 2 O 4 2 - + MnO 4 -
| (1)5 2 16 10 2 8 (2)①0.005 ②A.氧化剂 不需要 无色 浅紫红色 B.无影响 C.偏小 ③21% 64% |
| (1)C:+3―→+4,改变量(4-3)×2=2,Mn:+7―→+2,改变量(7-2)×1=5,根据化合价升降总数相等,所以在C 2 O 4 2 - 前配5,MnO 4 - 前配2,根据C和Mn原子守恒,分别在CO 2 和Mn 2 + 前配10和2,再由电荷守恒在H + 前配16,最后根据离子方程式两边的H原子个数相等在水前面配8,经检验离子方程式的氧原子个数相等。 (2)①由H + +OH - =H 2 O知,n(H + )=n(OH - )=0.25 mol·L -1 ×0.02 L=0.005 mol。②原溶液无色,而KMnO 4 为紫红色,所以当溶液中的H 2 C 2 O 4 和KHC 2 O 4 反应完全时,溶液呈浅紫红色。由得失电子守恒得,n(还)×2=0.10 mol·L -1 ×0.016 L×5,n(还)=0.004 mol。③设6.0 g试样中H 2 C 2 O 4 ·2H 2 O、KHC 2 O 4 的物质的量分别为n(H 2 C 2 O 4 ·2H 2 O)、n(KHC 2 O 4 ),由①得:2n(H 2 C 2 O 4 ·2H 2 O)+n(KHC 2 O 4 )=0.05 mol,由②得:n(H 2 C 2 O 4 ·2H 2 O)+n(KHC 2 O 4 )=0.04 mol,解上述两个方程式得:n(H 2 C 2 O 4 ·2H 2 O)=0.01 mol,n(KHC 2 O 4 )=0.03 mol,H 2 C 2 O 4 ·2H 2 O的质量分数为 ×100%=21%,KHC 2 O 4 的质量分数为 ×100%=64%。 |