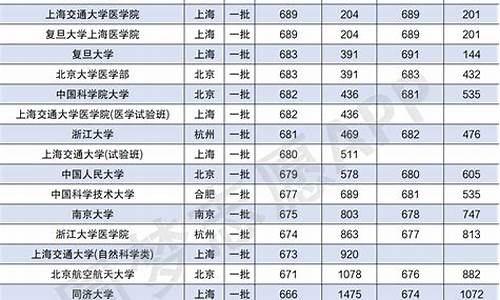
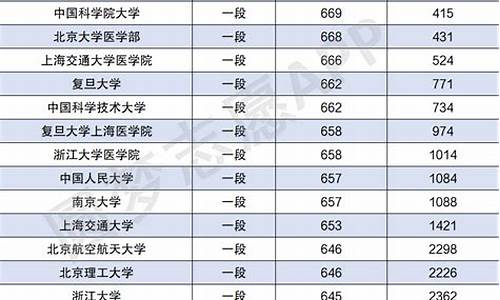
您现在的位置是: 首页 > 录取信息 录取信息
2014高考化学试题汇编及答案-2014高考化学试题汇编
tamoadmin 2024-08-13 人已围观
简介1.化学选修三物质的结构与性质近几年高考题可以没答案2.上海高考化学计算题汇编,追70分化学选修三物质的结构与性质近几年高考题可以没答案物质结构理论高考题汇编1.[2011·安徽卷] 中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是( )A.由同周期元素的第一电离能变化趋势,推出Al第一电离能比Mg大B.由主族元素最高正化合价与族序数关系,推出卤素最高正价都是+7C.由
1.化学选修三物质的结构与性质近几年高考题可以没答案
2.上海高考化学计算题汇编,追70分
化学选修三物质的结构与性质近几年高考题可以没答案

物质结构理论高考题汇编
1.[2011·安徽卷] 中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是
( )
A.由同周期元素的第一电离能变化趋势,推出Al第一电离能比Mg大
B.由主族元素最高正化合价与族序数关系,推出卤素最高正价都是+7
C.由溶液的pH与溶液酸碱性关系,推出pH=6.8的溶液一定显酸性
D.由较强酸可制较弱酸规律,推出CO2通入NaClO溶液中能生成HClO
2.[2011·天津卷] 以下有关原子结构及元素周期律的叙述正确的是( )
A.第ⅠA族元素铯的两种同位素137Cs比133Cs多4个质子
B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小
上海高考化学计算题汇编,追70分
七、(本题共16分)
30.臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2?放 电?2O3。
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为_____g/mol(保留一位小数)。
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为______L。
(3)实验室将氧气和臭氧的混合气体0.896 L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6 g。则原混合气中臭氧的体积分数为_________。
31.烟气中NOx是NO和NO2的混合物(不含N2O4)。
(1)根据废气排放标准,1 m3烟气最高允许含400 mg NOx。若NOx中NO质量分数为0.85,则1 m3烟气中最高允许含NO__________L(标准状况,保留2位小数)。
(2)工业上通常用溶质质量分数为0.150的Na2CO3水溶液(密度1.16 g/mL)作为NOx吸收剂,该碳酸钠溶液物质的量浓度为__________mol/L(保留2位小数)。
(3)已知:NO+NO2+Na2CO3?2NaNO2+CO2 ①
2NO2+Na2CO3?NaNO2+NaNO3+CO2 ②
1 m3含2000 mg NOx的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟气__________排放标准(填:符合、不符合),理由:______________________
(4)加入硝酸可改变烟气中NO和NO2的比,反应为:NO+2HNO3?3NO2+H2O
当烟气中n(NO):n(NO2)=2:3时,吸收率最高。
1 m3烟气含2000 mg NOx,其中n(NO):n(NO2)=9:1。
计算:(i)为了达到最高吸收率,1 m3烟气需用硝酸的物质的量(保留3位小数)。
(ii)1 m3烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(设上述吸收反应中,反应 ① 比反应 ② 迅速。计算结果保留1位小数)。
七、(本题共16分)
30.生态农业涉及农家废料的综合利用,某种肥料经发酵得到一种含甲烷、二氧化碳、氮气的混合气体。2.016 L(标准状况)该气体通过盛有红热CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuOCO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产生的气体通过过量的澄清石灰水中,充分吸收,生成沉淀8.5 g。
(1)原混合气体中甲烷的物质的量是_____
(2)原混合气体中氮气的体积分数为_____
31.小苏打、胃舒平、达喜都是常用的中和胃酸的药物。
(1)小苏打片每片含0.50 g NaHCO3,2片小苏打片和胃酸完全中和,被中和的氢离子是_____mol。
(2)胃舒平每片含0.245 g Al(OH)3。中和胃酸是,6片小苏打片相当于胃舒平_____片。
(3)达喜的化学成分是铝和镁的碱式盐。
① 取该碱式盐3.01 g,加入2.0 mol/L盐酸使其溶解,当加入盐酸42.5 mL时开始产生CO2,加入盐酸至45.0 mL时正好反应完全,计算该碱式盐样品中氢氧根与碳酸根的物质的量之比。
② 在上述碱式盐溶于盐酸后的溶液中加入过量氢氧化钠,过滤,沉淀物进行干燥后重1.74 g,若该碱式盐中氢元素的质量分数为0.040,试推测该碱式盐的化学式。
七、(本题共16分)
30.一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。
(1)原NaOH溶液的质量分数为_____
(2)所得溶液中Cl?的物质的量为_____mol。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=_____
31.钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物。
(1)钾和硝酸钾反应可制得K2O(10K+2KNO3?6K2O+N2),39.0g钾与10.1g硝酸钾充分反应生成K2O的质量为 g。
(2)某过氧化钾样品中氧的质量分数(杂质不含氧)为0.28,则样品中K2O2的质量分数为_____
(3)超氧化钾和二氧化碳反应生成氧气(4KO2+2CO2?2K2CO3+3O2),在医院、矿井、潜水、高空飞行中用作供氧剂。13.2 L(标准状况)CO2和KO2反应后,气体体积变为18.8 L (标准状况),计算反应消耗的KO2的质量。
(4)KO2加热至600℃部分分解得到产物A。6.30 物A充分吸收二氧化碳生成碳酸钾并产生氧气1.12 L(标准状况),试确定产物A中钾氧两种原子个数之比。如果产物A只含有两种化合物,写出所有可能的化学式并计算A中两种化合物的物质的量之比。
七、(本题共16分)
30.合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3。
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4:5,其中Fe2+与Fe3+物质的量之比为_____
(2)当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为_____(用小数表示,保留2位小数)。
(3)以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2Fe2O3+C?高 温?4FeO+CO2?。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
31.已知:4NH3+5O2?一定 条件?4NO+6H2O;4NO+3O2+2H2O?4HNO3。
设空气中氧气的体积分数为0.20,氮气体积分数为0.80,请完成下列填空及计算:
(1)a mol NO完全转化为HNO3需要氧气_____mol;
(2)为使NH3恰好完全氧化为一氧化氮,氨-空气混合物中氨的体积分数为_________(保留2位小数)。
(3)20.0 mol的NH3用空气氧化,产生混合物的组成为:NO 18.0 mol、O2 12.0 mol、N2 150.0 mol和一定量的硝酸,以及其它成分(高温下NO和O2不反应)。计算氨转化为NO和HNO3的转化率。
(4)20.0 mol的NH3和一定量空气充分反应后,再转化为HNO3。
① 在下图中画出HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线。
② 写出当125≤n(B)≤200时,n(A)和n(B)的关系式_____________________
上一篇:高考考题广东-广东高考试题卷