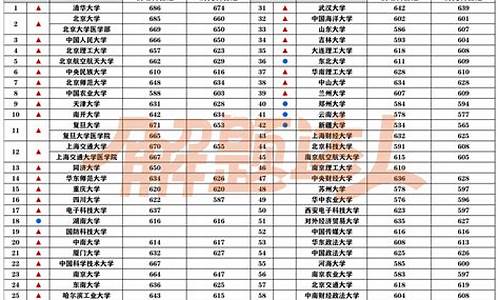
您现在的位置是: 首页 > 教育研究 教育研究
高考化学平衡大题,高考化学平衡
tamoadmin 2024-05-25 人已围观
简介1.高中化学可逆反应平衡转化问题拜托2.高二化学平衡问题,这个应该是一道高考题,综合性较强。求详解(4、5、6问,其他的不要,必须详解)3.一道化学平衡高考题,怎么会推出矛盾?4.一道高考化学平衡题答案为B. 甲与丙等价,就不多说了.现在分析A, C, D为什么错.假设甲的体积是乙的两倍, 那么达到平衡时, 甲与乙有相同的终态, 只是甲中的SO2, O2和SO3分别是乙的两倍. 好, 此时对甲加压
1.高中化学可逆反应平衡转化问题拜托
2.高二化学平衡问题,这个应该是一道高考题,综合性较强。求详解(4、5、6问,其他的不要,必须详解)
3.一道化学平衡高考题,怎么会推出矛盾?
4.一道高考化学平衡题

答案为B. 甲与丙等价,就不多说了.现在分析A, C, D为什么错.假设甲的体积是乙的两倍, 那么达到平衡时, 甲与乙有相同的终态, 只是甲中的SO2, O2和SO3分别是乙的两倍. 好, 此时对甲加压使其体积与乙一样, 并假设甲的平衡不移动, 那么甲的压力应是乙的两倍, 但是平衡是移动的而且朝SO3一侧移动, 这样甲中的总物质的量就会减少, 所以甲的压力小于乙的两倍. B是一个分析方法, C显然是错的应相等. 由于热量与体系状态有关,虽然甲反应的量比乙的两倍还多, 但释放的热量不一定是乙的两倍, 因为这与体系的压力是有关的.
高中化学可逆反应平衡转化问题拜托
等效平衡是指几个可逆反应,在相同的条件下,不同的起始状态,达平衡时终态相同或成等比。
可分为“完全等效平衡”和“等比等效平衡”
判断方法:先将杂乱的物质的摩尔数通过化学方程式都转化成反应物(或生成物)的摩尔数,再看这几个反应中反应物(或生成物)的摩尔数是否完全一样(完全等效平衡)或 是否成等比(等比等效平衡)
如N2+3H2——2NH3
N2 H2 NH3
①1mol 4mol
② 1mol 2mol
③0.5mol 2mol
因为将②中将生成物2molNH3全部转化成反应物后,反应物中各物质的物质的量就与①完全一样,所以①与②是完全等效平衡;而③中反应物的量正好都是①中反应物的量的一半,即成等比,所以①与③属于等比等效平衡。
高二化学平衡问题,这个应该是一道高考题,综合性较强。求详解(4、5、6问,其他的不要,必须详解)
1.化学计量数相等时,改变反应物浓度,压强改变,但因为反应前后物质的量不变,因此压强不会影响到化学平衡,(即化学平衡不会发生移动,反应物本应该反应多少还是反应了多少,)所以反应物的转化率也就不会改变。
2反应后物质的量增大的反应,增大反应物的浓度,压强增大,反应向物质的量减小的方向进行,(即化学平衡逆向移动,反应物本应该反应多少却因为化学平衡逆向移动少反应了一点,)所以反应物的转化率减小。
3.反应后气体物质的量减小的反应,增大反应物的浓度,压强增大,化学反应向着物质的量减小的方向进行,(即化学平衡正向移动,反应物本应该反应多少却因为化学平衡正向移动多反应了一点,)所以反应物的转化率增大。
一道化学平衡高考题,怎么会推出矛盾?
1.1.2 mo1·L—1/2 min= 0.6 mo1·L—1·min—1
2.0.8mo1x/2L=1.2 mo1·L—1
3.A的转化率与B的转化率之比=(1.6/2):(0.8/2)=2:1
4.X=3时该反应为等体积反应,不论平衡与否压强始终不变化A项错;D为固体,气体密度不再变化时平衡B项正确;气体平均相对分于质量不再变化 时平衡C项正确;在整个过程A的消耗速率与B的消耗速率之比总为2∶1
5.6.利用”等比等效平衡“解答即可
一道高考化学平衡题
看了上面几位高手的回答,感觉他们没有找到问题的根源。
一边倒的方法解决这个题目是没问题的,只是这里你的思维不够严密。你解决这道题的思考是不准确的。一边倒以后系统里面只有A和B,不要再去考虑C了,只把C的变化等效给A和B就行了,我想这一点你是很明确的。
第一种说法得出的结果是合理的,可以这样验证,如果只增加1molA,0.5molB,和1molC,那么平衡还是不动,但现在又加了0.5molB,所以平衡右移了。结果正确的根本原因是后来增加的0.5molB是在不影响现有A的物质的量的基础上进行的对平衡的改造,所以平衡自然打破,向右寻求新的平衡。
而第二种分析方法中,“11molA+5.5molB平衡后又减少了1molA”这时候必然会引起系统里面B的含量的变化,也就是说在现有11molA+5.5molB的平衡系里面,每减少1molA就会减少0.5molB,而这些减少的B你没有考虑到。
可以这样去分析第二种情况,11molA+5.5molB平衡后又减少了1molA,这时候相应的减少了0.5molB,系统达到10molA + 5molB的平衡,但距离 10molA + 5.5molB还差0.5mol的B,于是可以按照第一种思路去分析,得出平衡向右移动的结论。
第二种减物质的思路我似乎没用过。
(4)体积不变,后者相当于在原有的基础上增加压强,平衡向正向移动,转化率增大!
(6)等效平衡,把3mol的x物质极值转化成右侧y和z物质,z的最大量是4.5mol:平衡时z的物质的量为0.9mol,又要保持平衡向逆向移动,所以要大于0.9mol小于等于4.5mol,希望你能理解!
上一篇:对口专业高考考什么_对口专业高考